Cette section s'adresse essentiellement aux aquariophiles les plus expérimentés, possédant quelques notions de chimie et désireux d'approfondir leurs connaissances afin de mieux optimiser soit le développement de plantes exigeantes, soit la reproduction d'espèces difficiles.
Nous présentons donc les aspects théoriques de cette technique d'injection de CO2 aux amateurs convertis à ses avantages.
■ Théorie sur l'injection de dioxyde de carbone CO2
■ Processus de base
Le dioxyde de carbone est capté dans l'eau par deux processus, la photosynthèse et la dissolution.
■ Le processus photosynthèse
Le processus photosynthèse est essentiel pour le développement des plantes, il utilise le dioxyde de carbone CO2 et l'énergie lumineuse pour générer des nutriments aux plantes sous forme d'hydrate de carbone ou glucose CH2O et diffuser au sein de l'eau du dioxygène O2 conformément à l'équation :
CO2 + H2O + énergie lumineuse ⇨ CH2O + O2
► Pour en savoir plus consultez ☛ Le processus de photosynthèse
■ Le processus de dissolution du CO2
Le processus de dissolution du CO2 est d'autant plus important qu'il y a un excès de CO2 par rapport aux besoins des plantes, dans ce cas il crée de l’acide carbonique H2CO3
CO2 + H2O ⇔ H2CO3
Cet acide carbonique se dissocie en libérant des ions hydrogénocarbonate HCO3- et hydrogène H+ lequel est chimiquement un acide :
H2CO3 ⇔ HCO3- + H+
L'ion hydrogène acide H+ s'hydrate pour former un ion oxonium acide H3O+ soit :
H2CO3 + H2O ⇔ H3O+ + HCO3- (1)
Finalement la dissolution d'une molécule de dioxyde de carbone CO2 dans l'eau génère un ion hydrogénocarbonate HCO3- et un ion oxonium H3O+.
Top ▲■ Réactions des ions HCO3- et H3O+ en fonction du pH de l'eau
Le pH contrôle ces différentes réactions chimiques, si dans l'eau la concentration en ions H+ ou son équivalent H3O+, varie en plus ou en moins, ce qui correspondant respectivement à une baisse ou un accroissement du pH, il y a automatiquement rééquilibrage pour respecter la constante d'équilibre de l'eau Ke. Cet équilibre est obtenu par une réduction ou une augmentation des hydrogénocarbonates.
► Pour en savoir plus consultez ☛ Le pH et la constante d'équilibre de l'eau
■ Le milieu est acide et le pH est inférieur à 7
• Les ions d'hydrogénocarbonate HCO3- s’associent au magnésium, mais surtout au calcium pour former un hydrogénocarbonate de calcium Ca(HCO3)2, dit bicarbonate de calcium, suivant la formule :
2HCO3- + Ca2+ ⇨ Ca(HCO3)2
Cet hydrogénocarbonate de calcium est soluble dans l'eau.
• Les ions acides H+ ou H3O+ restant seront absorbés par les hydrogénocarbonates si ceux-ci sont encore en quantité suffisante, ce qui est le cas lorsque le KH est suffisamment important, mais si le KH est trop faible, alors la quantité d’ions acides croit et le pH baisse.
■ Le milieu est basique et le pH est supérieur à 7
• Les ions hydrogénocarbonate HCO3- s’associent au calcium pour former du carbonate de calcium CaCO3 :
HCO3- + H2O ⇨ H3O+ + CO32-
H3O+ + CO32- + Ca2+ ⇨ H3O+ + CaCO3
Ce carbonate de calcium n'est pas soluble dans l'eau, il se dépose sous forme de calcaire sur les parois ou les plantes, il est présent dans tous les aquariums dont le pH est supérieur à 8 ou 8,5.
Dans un milieu acide le carbonate de calcium se transforme en hydrogénocarbonate de calcium soluble dans l'eau.
• Les ions acides H+ ou H3O+ restant ou nouvellement générés seront absorbés par les hydrogénocarbonates car ceux-ci sont en quantité importante lorsque le pH est élevé.
■ Il y un déficit en CO2 pour les plantes
Les plantes en cas d'insuffisance de CO2 extraient celui-ci des hydrogénocarbonates HCO3 suivant l'équation suivante :
2HCO3- + Ca2+ ⇨ CO2 +H2O + CaCO3
On obtient du CO2 consommé par les plantes, de l'eau et du carbonate de calcium CaCO3 qui se dépose. La consommation de CO2 entraine une hausse du pH et une baisse du KH.
♦ Il arrive parfois dans un aquarium, après une longue période de temps, que la dureté carbonatée KH baisse et que l'on voit apparaitre des dépôts blanchâtres de carbonate de calcium CaCO3 sur les feuilles, le sol ou les vitres. Ce phénomène est dû à une insuffisance importante de dioxyde de carbone CO2 dans un aquarium trop planté avec une population insuffisante.
Top ▲■ Variation des concentrations en CO2, HCO3- et CO32- en fonction du pH
Les taux de concentration dans l'eau du dioyde de carbone CO2, des ions carbonate CO32- et hydrogénocarbonate HCO3- varient en fonction du pH de l'eau.
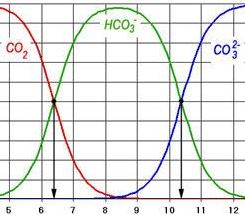
♦ Dans un aquarium d'eau douce, il n'y a pas d'ions carbonate CO32-.